COLORAZIONE ED OSSERVAZIONE DEI MICRORGANISMI - GIOVANNI DI BONAVENTURA, PH.D. CI "MICROBIOLOGIA E MICROBIOLOGIA CLINICA" CDS MEDICINA E CHIRURGIA ...
←
→
Trascrizione del contenuto della pagina
Se il tuo browser non visualizza correttamente la pagina, ti preghiamo di leggere il contenuto della pagina quaggiù
Colorazione ed osservazione
dei microrganismi
Giovanni Di Bonaventura, Ph.D.
CI «Microbiologia e Microbiologia Clinica»
CdS Medicina e Chirurgia
Università “G. d’Annunzio”, Chieti-Pescara
AA 2019-2020Le colorazioni in Microbiologia
Perché colorare ?
▪ La cellula batterica è trasparente contrasto insufficiente tra cellula
batterica ed ambiente circostante.
▪ L’utilizzo dei coloranti consente:
▪ forte contrasto tra i microrganismi ed il fondo
▪ differenziazione di vari tipi morfologici (forma, organizzazione,
colorazione Gram)
▪ evidenziazione di alcune strutture cellulari (flagelli, capsule, endospore)Le colorazioni in Microbiologia
I coloranti
- - - -
- -
▪ i batteri hanno carica superficiale negativa
- -
▪ i coloranti sono usati sottoforma di sali (presenza di gruppi cromofori ionici)
Coloranti basici (ioni positivi)
Blu di metilene
Fucsina basica + cromofori attratti da componenti acidi
Cristal violetto (superficie, proteine, acidi nucleici)
COLORAZIONE DIRETTA
Coloranti acidi (ioni negativi)
Eosina
Nigrosina - cromofori repellono la cellula batterica
(non penetrano la cellula)
COLORAZIONE INDIRETTA o NEGATIVALe colorazioni in Microbiologia
Preparativa
▪ Preparazione di soluzioni coloranti
▪ soluzione alcolica al 10% (colorante come sale):
▪ 10 g sostanza colorante + 100 ml alcool assoluto
▪ soluzione idroalcolica al 10% (colorante subisce dissociazione elettrolitica):
▪ 10 ml soluzione alcolica colorante + 90 ml H2O distillata
▪ Reagenti per colorazioni
▪ Mordenzanti: sostanze che fissano il colorante od amplificano l’ingombro del
campione (fenolo, soluzione iodo-iodurata o liquido di Lugol)
▪ Differenziatori: sostanze decoloranti (alcool-acetone, acido solforico al 20%)Le colorazioni in Microbiologia
Tipologie
• Colorazioni progressive: si eseguono con soluzioni molto diluite di colorante,
interrompendo tempestivamente la colorazione.
• Colorazioni regressive: si esegue una iper-colorazione, quindi una decolorazione
(differenziatore) la cui azione deve essere interrotta tempestivamente.
• Colorazioni semplici:
• un colorante basico viene applicato al campione per un tempo variabile; l’eccesso di
colorante viene eliminato tramite risciacquo con acqua
• consente di rilevare la morfologia e l’organizzazione cellulare
• esempi: blu di metilene, carbolfucsina
• Colorazioni differenziali:
• utilizzo di due o più coloranti ed altri reagenti (mordenzanti, differenziatori)
• consente di distinguere due (o più) differenti tipologie di microrganismi o loro strutture
• esempi: Gram, Ziehl-NeelsenTecniche di colorazione
Colorazioni differenziali
▪ Colorazione di Gram
▪ Colorazione per bacilli acido-resistenti:
▪ Metodo di Ziehl-Neelsen
▪ Metodo a freddo di Kinyoun
▪ Metodo della fluorescenza con auramina
▪ Colorazione della capsula (inchiostro di china)
▪ Colorazione di flagelli (Leifson)
▪ Colorazione di spore
▪ Colorazione di lieviti e funghi
▪ Colorazione di spirocheteLe colorazioni in microbiologia
Allestimento di un preparato (fissazione) 1
Prima di poter essere colorato, il preparato deve essere fissato al
supporto. La tecnica più utilizzata è la fissazione FISICA:
1. Con un’ansa, «stendere» il campione su un vetrino per microscopia:
▪ sospensione cellulare (brodocoltura), oppure
▪ colonie da terreno agarizzato (stemperare in soluzione tampone)
2. Lasciare essiccare il preparato all’aria
3. Esporre il vetrino (lato non contenente il campione) direttamente alla
fiamma di un «becco bunsen»
L’esposizione diretta al calore può alterare la morfologia cellulare (artefatti)
Fissazione CHIMICA: il fissativo (acetone, etanolo, acido acetico,
glutaraldeide, formaldeide) penetra nella cellula preservandone le 2
strutture intracellulari, grazie alla stabilizzazione di lipidi e proteine.
La fissazione:
▪ impedisce che il campione venga rimosso dal vetrino durante i lavaggi
▪ uccide i microrganismi (sicurezza per operatore)
▪ facilita la penetrazione del colorante nel preparato
▪ inattiva gli enzimi che potrebbero degradare le strutture cellulari (autolisi) 3
▪ preserva le strutture intracellulari (solo fissazione chimica)Colorazione di Gram
▪ Messa a punto dal batteriologo danese Hans Christian
Joachim Gram (13 Settembre 1853), nel tentativo di
differenziare Klebsiella pneumoniae da Streptococcus
pneumoniae
▪ La colorazione di Gram è la tecnica più frequentemente
utilizzata in diagnostica ed è in grado di suddividere i
batteri in due gruppi sulla base della loro differente
struttura parietale: Gram-positivi (Gram+) e Gram-
negativi (Gram-)Colorazione di Gram
Tecnica
1. Fissare il campione
2. Coprire con cristalvioletto per 1-2 min
3. Lavare con acqua; non asciugare
4. Coprire con la soluzione iodio-iodurata
di Lugol per 1-2 min
5. Lavare con acqua; non asciugare
6. Decolorare per 10 s con alcool-acetone
7. Lavare con acqua; non asciugare
8. Coprire con safranina (2.5% in alcool
95%) per 1-2 min
9. Lavare con acqua e lasciare asciugare
Colorazione di Gram: colorazione regressiva e differenzialeColorazione di Gram
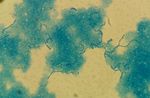
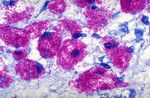
Osservazione microscopica Staphylococcus epidermidis
▪ I batteri Gram+ (es. Staphylococcus spp, Streptococcus
spp, etc) appaiono colorati in blu/porpora
▪ I batteri Gram- (es. E. coli, P. aeruginosa, Neisseriaceae,
etc.) appaiono colorati in rosso
▪ Nel caso di infezioni polimicrobiche (ossia sostenute da
più specie), il campo microscopico può presentare
evidenze sia per Gram+ che per Gram-
Escherichia coli
Infezione «polimicrobica»Colorazione di Gram
Utilità clinica
▪ Idoneità del campione da sottoporre a coltura
▪ Diagnosi eziologica presuntiva (suggestiva)
▪ meningiti e polmoniti batteriche, batteriuria, gonorrea ed infezioni piogene
▪ Suggerire la necessità di attuare tecniche di coltivazione “non routinarie”
▪ anaerobi, funghi
▪ Ausilio nella interpretazione dell’esame colturale
▪ angina di Vincent (spirochete, fusobatteri)
▪ paziente antibiotizzato
▪ Informazioni sulla natura dell’infezione
▪ infezioni poli/mono-microbiche
L’esecuzione di una colorazione di Gram può, in alcuni casi, salvare la vita del paziente !Colorazione di Gram Casi particolari La colorazione di Gram, classicamente utilizzata per i batteri, può occasionalmente rivelare la presenza anche di altri microrganismi: ▪ Trichomonas vaginalis (protozoo) è Gram+ ▪ Candida albicans (lievito), Aspergillus fumigatus (muffa) sono Gram+ ▪ Occasionalmente, anche Mycobacterium tuberculosis è Gram+ (oppure Gram-variabile)
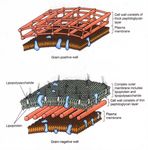
Mycobacterium spp.
Parete cellulare
La colorazione di Gram non è applicabile a tutti i batteri.
Mycobacterium tuberculosis (tubercolosi) e M. leprae (lebbra, Hansen’s disease)
posseggono una struttura parietale caratteristica:
• la natura “cerosa” dell’involucro esterno (grosse quantità di glicolipidi, scarso
petidoglicano) infatti rende la cellula altamente impermeabile ai coloranti
Colorazioni «dedicate»:
• Ziehl-Neelsen (colorazione «a caldo»)
• Kinyoun (coloreazione «a freddo»)Colorazione di Ziehl-Neelsen Tecnica 1. versare la fucsina fenicata (fucsina basica in acqua, alcool e fenolo) 2. far evaporare il colorante alla fiamma per 5 min; lavare con acqua 3. decolorare (2 min, circa) con alcool-acido fino alla scomparsa del colorante; lavare con acqua 4. contrastare con blu di metilene per 1-2 min; lavare con acqua
Colorazione di Ziehl-Neelsen
Osservazione microscopica
▪ Gli organismi acido-resistenti (AFB, Acid-Fast Bacilli) appaiono colorati in rosso
▪ Gli organismi non acido-resistenti risulteranno colorati in blu
Bonanno R. – Pol. Univ. MessinaLe colorazioni in Microbiologia Colorazioni speciali Nella colorazione negativa il colorante acido (nero nigrosina, inchiostro India) non è in grado di penetrare nella cellula batterica, quindi colorerà soltanto l’ambiente extracellulare. Evidenzia organismi o strutture non colorabili con tecniche classiche (es., spirochete, capsula cellulare). Il campione NON viene fissato (no artefatti). La colorazione delle spore (Schaffer-Fulton stain) richiede calore per facilitare la penetrazione del colorante (verde di malachite, fucsina fenicata) attraverso gli involucri sporali. La colorazione dei flagelli (Leison stain) impiega un mordenzante (sali dell’acido tannico) che, precipitando alla superficie flagellare, ne aumenta lo spessore. Il diametro flagellare è, di norma, pari a 12-30 nm (minore potere di risoluzione del microscopio ottico).
Le colorazioni in Microbiologia
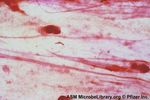
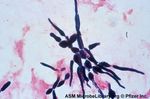
Colorazione di flagelli
Colorazione di Leifson. Cellule politriche di
Helicobacter pylori.
Le frecce indicano i flagelli: alcuni ancora in
contatto con il corpo cellulare, altri liberi.
(Di Bonaventura et al., J. Clin. Microbiol., 1997)Osservare «l’invisibile» Microscopio
Osservazione al microscopio
Microscopio ottico
• L’immagine viene ingrandita sia a livello delle lenti dell’obiettivo
che attraverso quelle dell’oculare:
Necessario per
osservazione di
batteri e funghi
La risoluzione (R) è la capacità delle lenti di distinguere due punti vicini:
• il microscopio ottico ha un potere di risoluzione di 0.2 µm, cioè in grado di distinguere due
punti se distanti almeno 0.2 µm
• luce a lunghezza d’onda minore fornisce una maggiore risoluzione: R = 0.5 λ / n sinα
(λ: lunghezza d’onda; n: indice di rifrazione; α: angolo del cono luminoso)Osservazione al microscopio Microscopio ottico ▪ L’indice di rifrazione di un mezzo misura la sua capacità di deviare la luce. ▪ In aria, la luce potrebbe deviare il suo cammino così tanto da non essere intercettata dalle piccole lenti di ingrandimento. ▪ Per questo, l’osservazione viene effettuata in immersione, ossia in un mezzo (olio) in grado di ridurre la deviazione (rifrazione) della luce.
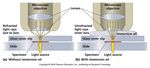
Osservazione al microscopio Campo chiaro e campo scuro Il campione viene fissato e colorato. CHIARO ▪ il campione è visualizzato grazie alla luce che passa direttamente dal condensatore al vetrino ▪ la luce riflessa dal campione NON entra nell’obiettivo ▪ gli oggetti scuri sono visibili su fondo luminoso SCURO ▪ viene usato un condensatore che impedisce alla luce trasmessa di illuminare direttamente il campione: questo è raggiunto dalla luce diffusa solo se obliqua e risulta stagliato su uno sfondo nero. ▪ la luce NON attraversa il campione: studio dei contorni ma non dei dettagli interni. ▪ potere risoluzione = 10x campo chiaro.
Osservazione al microscopio Contrasto di fase ▪ Il campione viene fissato e colorato. ▪ Il principio di base è l'amplificazione delle differenze di fase di fasci paralleli di luce che attraversano oggetti di densità diversa: la luce «in fase» risulta più chiara rispetto a quella «fuori fase». ▪ Accentuata diffrazione della luce che attraversa il campione. ▪ In tal modo, si creano immagini tridimensionali del campione, permettendo analisi dettagliate delle sue strutture interne.
Osservazione al microscopio
Microscopia in fluorescenza
• Utilizza la luce UV: ad una pari a 200-400 nm le strutture sono analizzate in base
alla fluorescenza che emettono nello spettro visibile.
• Fluorescenza: capacità di alcuni composti (fluorocromi) di assorbire radiazioni
elettromagnetiche di una certa e di emettere una frazione dell’energia assorbita
con radiazione elettromagnetiche a superiore a quella assorbita.
• I fluorocromi possono essere coniugati a Ab, per la ricerca specifica di Ag
(immunofluorescenza).
• Tecnica impiegata soprattutto per la ricerca di microrganismi difficilmente coltivabili:
• virus influenzali, Adenovirus, Coronavirus, Treponema pallidum, Borrelia burgdorferiOsservazione al microscopio
Microscopia in fluorescenza
Adenovirus Coronavirus
Giardia intestinalis
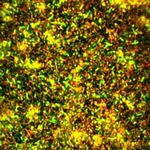
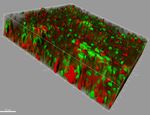
Mycobacterium tuberculosis Candida albicansOsservazione al microscopio Microscopia in fluorescenza (CLSM) – osservazione di biofilm batterici Biofilms formato da Pseudomonas aeruginosa isolato da paziente FC: I biofilms, formati a seguito di incubazione a 37°C per 24 h, sono stati marcati con: Syto-9 [6 µM] (fluorescenza verde: cellule vitali) + Ioduro di Propidio [30 µM] (fluorescenza rossa: cellule morte). (Images from Di Bonaventura’s lab – UdA)
Osservazione al microscopio
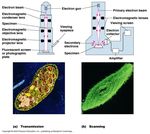
Microscopio elettronico
▪ Il campione viene disidratato, incluso in
resina, colorato con sali di metalli
pesante e sezionato all’ultramicrotomo
▪ Utilizza un fascio di elettroni al posto
della luce (λ = 0.005 nm)
▪ Potere risoluzione 1.000 volte maggiore
vs ottico
▪ Il fascio elettronico è focalizzato, nel
vuoto, sul campione da magneti (lenti
elettromagnetiche):
▪ Trasmissione (TEM): sezione sottile
▪ Scansione (SEM): 3DOsservazione al microscopio
Microscopio elettronico – SEM e TEM
SEM. Rhabdovirus SEM. Escherichia coli
TEM. Vibrio cholerae su mucosa intestinale
TEM. OrthomyxovirusOsservazione al microscopio
(Images from Di Bonaventura’s lab – UdA)
Microscopio elettronico – SEM di biofilm batterici e fungini
Myroides odoratimimus
Pseudomonas aeruginosa
Trychosporon asahii Staphylococcus aureusQuesto materiale non può essere distribuito, modificato o pubblicato né in forma cartacea, né su un sito, né utilizzato per motivi pubblici o commerciali. E’ possibile utilizzare il materiale solo per motivi personali e non commerciali, purché ogni copia di questo materiale preservi tutti i diritti di copyright e di proprietà intellettuale, sempre a seguito di formale richiesta rivolta all’Autore (Prof. Giovanni Di Bonaventura; gdibonaventura@unich.it)
Puoi anche leggere